ゼミブログ
化学基礎ワンポイント学習法⑪|三条校
2022年07月05日

【酸化還元反応式】◎三条市・東三条駅前の塾・真友ゼミ三条校スタッフによる高校受験・大学受験勉強方法・進路受験情報ブログ!
さぁ今回は酸化還元反応式を立てられるよう学習していきましょう!
酸化剤の半反応式と還元剤の半反応式を組み合わせてできるのが「酸化還元反応式」です。
それでは作り方を説明していきますよ。
①2つの半反応式の電子(e–)の数が揃うように調節する
②2つの式を足し合わせる
③反応物であるイオンの対となるイオンを加えて、式からイオンを消す
(イオン式から通常の反応式へ)
酸化還元反応式の作り方は、この3STEPです。
実際にやってみましょう。
硫酸酸性のニクロム酸カリウム水溶液にシュウ酸ナトリウム水溶液を加えたときの反応式を書いてみます。
①2つの半反応式の電子(e–)の数が揃うように調節する
(半反応式は前回の内容を参考に作ってみてください!)
今回は、シュウ酸ナトリウムの式に3をかけると2つの式の電子の数が揃います。

②2つの式を足し合わせる
次に、2つの式を足し合わせましょう。
両辺にある6e–は打ち消されるので下のようになります。
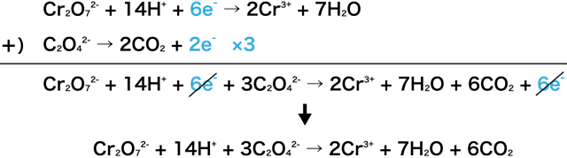
③反応物であるイオンの対となるイオンを加えて、式からイオンを消す
(イオン式から通常の反応式へ)
この反応は、ニクロム酸カリウム水溶液とシュウ酸ナトリウム水溶液の反応なので、この2つが左側(スタートの物質=反応物)にいなければなりません!
なので、左辺に2K+と6Na+を加えます。(2K+はCr2O72-とくっついてK2Cr2O7に、6Na+は3C2O42-とくっついて3Na2C2O4になります。)
これで完成!・・・ではなく、勝手に左に加えて終わりにしてしまったら式は成り立たなくなってしまうので、右辺にも2K+と6Na+を加えます。その結果以下のようになります。

※今回は硫酸酸性の水溶液なので、H+の出所はH2SO4となります。したがって、式中のH+にはSO42-をくっつけ、紫で囲んだところはまとめてK2SO4と3Na2SO4にしましょう。
これで完成!
酸化還元反応式は、「半反応式を立てる→電子をそろえる→式を合わせる→足りないものを補う」という流れです。
テストに出ない訳がないと言える分野なのでしっかりと身につけていきましょう!
