ゼミブログ
化学基礎ワンポイント学習法⑦|三条校
2022年03月23日

【中和反応の量的関係】◎三条市・東三条駅前の塾・真友ゼミ三条校スタッフによる高校受験・大学受験勉強方法・進路受験情報ブログ!
今回は中和反応の量的関係をやっていきたいと思います。
まず、中和反応とは「酸と塩基が反応して水と塩ができる」反応でした。
つまり、中和反応では酸のH+と塩基のOH–が結びついてH2Oができるので
H+ + OH– → H2O
の化学反応が起きます。
この酸のH+と塩基のOH–が過不足なく反応しているときで、中和点になります。
この中和点のとき
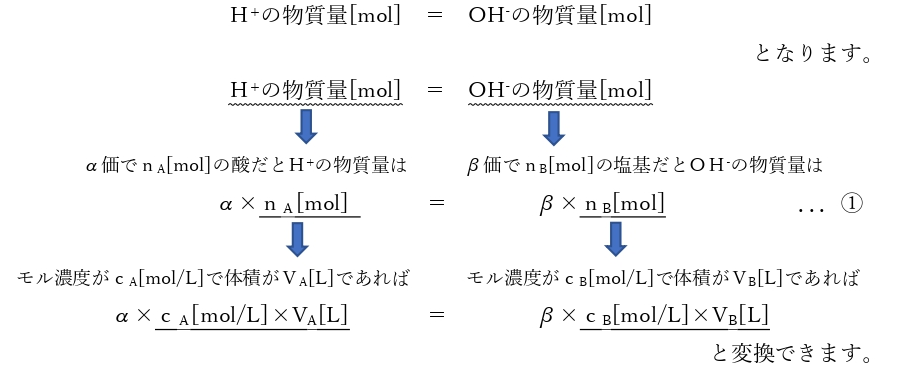
さらに問題によっては体積が[L]ではなく[mL]で出てきます。
むしろ、[mL]で出てくることの方が多いです!
酸の体積がvA[mL]、塩基の体積がvB[mL]のとき、それぞれvA/1000[L]、 vB/1000[L]と単位を変換して計算します。そうすると…
α×cA[mol/L]×vA/1000[[L] = β×cB[mol/L]×vB/1000[L] ...②
と変換して計算します。
この式変換に関しては、それぞれを暗記するというよりも「物質量をどう出すか…」というのがしっかりできると、中和点のときは「H+の物質量[mol]=OH–の物質量[mol]」を覚えておくだけで計算できます!
物質量の計算は今まででやってきた範囲でも重要なので、「できない…」と思った人は必ず復習しましょう!
2つ例題をやってみましょう。
①H2SO4水溶液0.20molと中和するNaOH水溶液の物質量(X[mol])と質量(Y[g])を求めてみましょう。(NaOH=40)
H2SO4とNaOHは中和しているので上記の①の式を使って物質量を求めます。

この2つの例題のように、問われるものが物質量や質量、体積だったりするものや濃度を問われたりと様々で式もたくさんあるように思いますが、基本的な式は上記の①のみ!
あとは「物質量を変換して応用する!」が基本的なことになります。求めたいものに合わせて式を変換できるようになりましょう。
